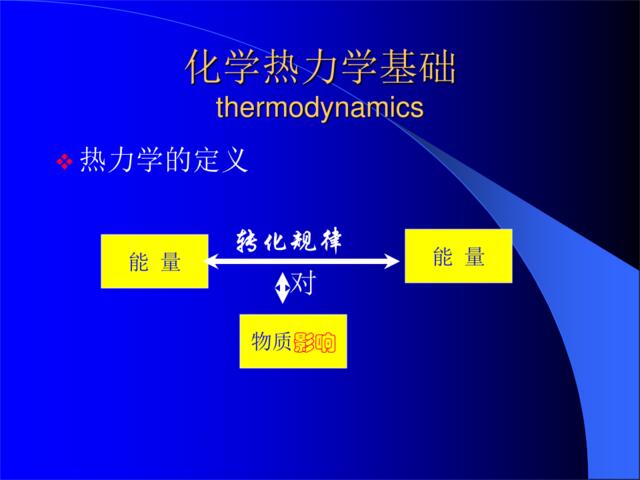
化学热力学基础thermodynamics热力学的定义转化规律对能量能量物质影响化学热力学1定义将热力学的基本原理用来研究化学现象以及和化学有关的物理现象的科学2研究内容化学和物理变化中的能量转换问题化学和物理变化进行的方向和限度3研究对象宏观的由大量质点组成的体系。①统计意义,不适用于个别原子、分子。②只需知道被研究对象的起始状态,以及变化时的条件,就可进行相应的计算,不需考虑物质的微观结构和反应机理。③热力学研究不涉及速率问题。4特点是一种演绎的方法。它结合热力学三大基本定律,讨论具体对象的宏观性质。5近代化学三大基础理论化学热力学、化学动力学和物质结构理论1.1基本概念(Baseconcept)1.1.1体系(system)与环境(surroundings)1体系:研究对象的物质或空间2环境:体系以外与体系密切相关的其它部分3体系分类:敞开(Open)体系:既有物质交换又有能量交换。封闭(Closed)体系:没有物质交换只有能量交换。孤立(isolated)体系:既无物质交换也无能量交换。1.2热化学(thermo-chemistry)和焓(enthalpy)1.2.1热力学第一定律(firstlawofthermodynamics)Ⅰ能量守恒与转化定律自然界的一切物质都具有能量,能量有各种不同形式,可以从一种形式转化为另一种形式,可以从一种物质传递到另一物质,在转化和传递过程中总能量不变。Ⅱ热力学第一定律1定义2研究对象研究的宏观静止体系,不考虑体系整体运动的动能和体系在外力场中的位能1.2.2焓与化学反应的热效应Ⅰ焓H(enthalpy)⒈条件W非体=0;P始=P终=P外⒉推导Q=△U+WQP=△U+P△V=(U2-U1)+P外(V2-V1)=(U2+P2V2)-(U1+P1V)⒊定义H=U+PVⅡ热效应1定